 Cours d'extraction liquide-liquide: représentation des équilibres d'un mélange ternaire
Cours d'extraction liquide-liquide: représentation des équilibres d'un mélange ternaire
Diagramme triangulaire équilatéral

La représentation dans le diagramme triangulaire équilatéral permet, en plaçant un point M, de trouver les compositions (en général le titre massique) de chacun des constituants du mélange ternaire.
Pour cela, il suffit de tracer à partir du point M des segments de droites parallèles aux bases et opposés aux sommets, et de lire les titres sur les axes formés par les bases.
Chaque sommet représente un constituant pur du ternaire. Le sommet inférieur droit représente le solvant, le sommet supérieur représente le soluté. Le dernier sommet (inférieur gauche) représente évidement le diluant.
Exemple de lecture pour le point M représenté:
- titre en solvant 40% (base inférieure)
- titre en soluté 30% (base côté droit)
- titre en diluant 30% (base côté gauche)
Rq: le titre en diluant est également le complémentaire à 100% des titres en solvant et soluté.
Sur ce diagramme, la courbe tracée à l'intérieur du triangle représente la limite de miscibilité des deux phases liquides. En dessous de la courbe, le mélange représenté par le point M est hétérogène et décante en deux phases liquides. Au dessus de la courbe, le mélange représenté par le point M serait homogène (le soluté solubilise ensemble solvant et diluant, normalement non totalement miscibles entre eux).
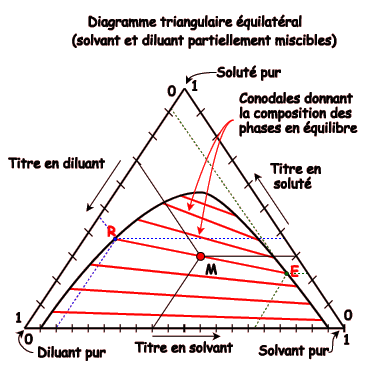
Pour représenter les équilibres du soluté dans chaque phase liquide, il convient de tracer dans la zone de non-miscibilité des droites nommées connodales, dont les extémités représentent chacune des phases (points R et E, pour raffinat et extrait).
Ainsi, le mélange non homogène représenté par M décante en deux phases liquides homogènes, l'une représentée par le point R, riche en diluant et nommée raffinat, l'autre représentée par le point E, riche en solvant et nommée extrait.
Ces diagrammes sont établis expérimentalement pour un ternaire donné. On peut par exemple, en partant d'un mélange diluant+soluté de composition connue, rajouter du solvant jusqu'à apparition du point de trouble, ce qui donne un des points de la connodale.
Les points de la courbe de miscibilité situés sur la base inférieure du triangle donnent les miscibilités réciproques du solvant et du diluant (ici 5% de solvant dans le diluant et 5% de diluant dans le solvant). En cas d'immiscibilité totale, la courbe de miscibilité part des sommets inférieurs du triangle.
Rq: la représentation des mélanges ternaires dans le diagramme triangulaire équilatéral n'est pas au programme des BTS Chimie. On utilise alors la représentation dans le diagramme triangulaire rectangle, très similaire (voir ci-dessous).
Diagramme triangulaire rectangle

Le diagramme triangulaire rectangle permet de représenter le comportement d'un mélange ternaire de la même façon que le diagramme triangulaire équilatéral, dont il est une projection. Il est parfois plus pratique car seuls deux axes othogonaux sont tracés, représentants respectivement le solvant (o,x) et le soluté (o,y).
La courbe de miscibilité et les connodales représentent les zones de miscibilité ou de présence de deux phases, et la composition des phases en équilibre.
Dans ce diagramme, la composition en diluant est déduite des compositions en solvant et soluté.

On considère ici une extraction à simple étage entre une alimentation F (40% de soluté, 60% de diluant, 0% de solvant), et une quantité S1 ou S2 (plus grande) de solvant pur.
Le mélange de F et de S1 donnera le point M1, situé sous la courbe de miscibilité, et qui décantera donc en deux phases R1 raffinat et E1 extrait dont les compositions peuvent être déterminées graphiquement.
Le mélange de la même charge F avec une quantité de solvant plus importante S2 donnera le point M2, également situé sous la courbe de miscibilité, et qui décantera donc en deux phases R2 raffinat et E2 extrait. On constate qu'avec plus de solvant, le raffinat sera moins riche en soluté (plus de soluté extrait), et que l'extrait sera également moins riche en soluté (plus de soluté extrait mais avec plus de solvant, d'ou un extrait moins concentré...)
Courbe de partage (solvant et diluant immiscibles)

Lorsque le solvant et le diluant peuvent être considérés comme totalemment immiscibles, ce qui est souvent le cas lorsque les titres en solutés restent faibles, beaucoup de choses peuvent être simplifiées. Tout d'abord, il n'est plus nécessaire de représenter chaque phase par les compositions en chacun des trois constituants puisque il n'y a pas de solvant dans les phases diluant (charge et raffinat), et qu'il n'y a pas de diluant dans les phases solvant (solvant et extraits).
En conséquence, on trace alors la répartition du soluté dans chaque phase en utilisant uniquement le titre massique (ou rapport massique) en soluté dans cette phase. Le titre en diluant ou en solvant, selon la nature de la phase considérée, est alors le complémentaire à 100% du titre en soluté.
Afin de distinguer les titres de chaque phase, on note x les titres en soluté dans les phases diluant (axe o,x), et y les titres en soluté dans les phases solvant (axe oy).
L'équilibre (ou partage) du soluté entre chaque phase est ainsi représenté par une courbe nommée courbe de partage.
Lorsque cette courbe peut être assimilée à une droite, son coefficient directeur est appelé coefficient de partage et noté m. L'équilibre entre les phases est alors traduit par l'expression y = m x.
Pour différentes raisons que nous n'évoquerons pas ici, on utilise préférablement les courbes d'équilibre ou de partage tracées en rapports massiques X et Y et non en titres massiques x et y.
Le rapport massique en soluté dans une phase diluant X (resp. Y dans une phase solvant) est le rapport entre la masse de soluté et la masse de diluant (resp. rapport entre la masse de soluté et la masse de solvant). On a ainsi les relations entre titres et rapports massiques suivantes:
- X=x/(1-x)
- Y=y/(1-y)
ou:
- x=X/(1+X)
- y=Y/(1+Y)

On considère ici une extraction à simple étage entre une alimentation F de rapport massique XF et une quantité S1 ou S2 (plus grande) de solvant contenant un peu de soluté (rapport massique YS).
Le mélange de F et de S1 donnera le point de coordonnées XR1 et YE1, représentant les compositions des deux phases raffinat R1 et extrait E1.
Le mélange de la même charge F avec une quantité de solvant plus importante S2 donnera le point de coordonnées XR2 et YE2, représentant les compositions des deux phases raffinat R2 et extrait E2. On constate qu'avec plus de solvant, le raffinat sera moins riche en soluté (plus de soluté extrait), et que l'extrait sera également moins riche en soluté (plus de soluté extrait mais avec plus de solvant, d'ou un extrait moins concentré...).
Le point bleu représente charge et solvant avant mélange. Il n'est pas sur la courbe de partage, donc lorsqu'on mélange les deux phases, la composition de celle-ci migre selon le segment vert. Si l'on atteint l'équilibre (agitation et temps de séjour suffisant), le point final obtenu est sur la courbe d'équilibre (point vert).
La droite verte représente ainsi le chemin parcouru par les deux phases en cours d'extraction. Cette droite est appelée droite opératoire. On démontre que dans la représentation courbe de partage en rapport massique, sa pente est négative et égale au rapport - (Diluant pur / Solvant pur).
Quand on augmente la quantité (ou le débit) de solvant, cette droite se rapproche de l'horizontale

Cette construction dite de McCabe et Thiele permet de déterminer le nombre d'étages d'équilibres réalisés par une installation, ou de déterminer le nombre d'étages d'équilibre nécessaire pour réaliser une séparation donnée.
Elle se démontre en rapport massique, et peut être réalisée avec une approximation suffisante en titre massique à condition que ceux-ci restent faibles (<10%).
La construction consiste à tracer deux points représentant chacun les deux extrémités de l'appareil:
l'un de coordonnées (XR,YS) représentant la sortie raffinat et l'entrée solvant,
l'autre de coordonnées (XF,YE) représentant l'entrée de la charge et la sortie de l'extrait.
On relie ensuite ces deux points selon une droite, nommée droite opératoire, dont on démontre que la pente est égale au rapport (Diluant pur / Solvant pur).
On trace enfin des marches d'escaliers entre la droite opératoire et la courbe d'équilibre, en partant d'un des points (haut ou bas de colonne) et jusqu'à dépasser l'autre. Le nombre de marches détermine le nombre d'étages d'équilibre ou le NET (pour nombre d'étages théoriques) de la colonne.
Copyright ©2024 Nicolas JOUVE. Tous droits réservés. / AZprocede at orange.fr
Compteur depuis le 16/10/2007: